
ph آب آشامیدنی
اسیدیته آب آشامیدنی عبارت است از ظرفیت کمی آب در خنثی سازی یک باز قوی و همچنین قلیائیت آب عبارت است از ظرفیت کمی آب در خنثی نمودن یک اسید قوی تا PH مورد نظر. این مقدار ممکن است با PH نقطه پایانی مورد نظر تغییر کند. قلیائیت به عنوان یکی از ویژگی های کلی و عمومی آب تعیین می شود
اسیدیته آب
مقدار اندازه گیری شده مستقیما به PH نقطه پایانی تیتراسیون بستگی دارد. اسیدیته به عنوان یک خاصیت کلی آب مطرح می گردد و گرنه تعیین و تفسیر مقدار دقیق آن منوط به روشن بودن ترکیب کامل شیمیایی آن است. عوامل متعددی در اسیدیته آب موثرند از جمله آن می توان اسید های معدنی قوی، اسید های ضعیف نظیر اسید کربونیک و اسیتک و نمک های هیدرولیز شونده مانند فرو سولفات و و آلومینیوم سولفات را ذکر کرد. اسیدیته آب با توجه به نقش موثرش در فرآیند های شیمیایی و یبوشیمیایی و در ضمن پدیده خوردگی فلزات از اهمیت زیادی برخوردار است.
اسیدیته آب با توجه به شناسه گر مصرفی بوده و به انواع فنل فتالئین ( تغییر رنگ 3/8) و متیل اورانژ ( تغییر رنگ 4) تقسیم بندی شده است. اگر در تیتراسیون از محل 02/0 نرمال سود استفاده شود و مقدار نمونه انتخابی 100 میلی لیتر باشد هر یک از اسیدیته بر حسب میلی گرم در لیتر کربنات کلسیم برابر میلی لیتر های حجم مصرفی سود ضربدر ده خواهد بود.
قلیائیت آب
قلیاییت آب عبارت است از ظرفیت کمی آب در خنثی نمودن یک اسید قوی تا PH مورد نظر. این مقدار ممکن است با PH نقطه پایانی مورد نظر تغییر کند. قلیاییت به عنوان یکی از ویژگی های کلی و عمومی آب تعیین می شود، در صورتی که تعیین مقادیر بر حسب هر یک از موارد مشخص مورد نظر باشد، باید ترکیب شیمیایی نمونه معلوم باشد.
مقدار قلیاییت برای آبهای طبیعی و یا پس آبهایی که مورد تصفیه قرار می گیرند مقدار متناهی است. با وصف اینکه قلیاییت آبهای سطحی عمدتا تابعی از مقادیر هیدروکسید، کربنات و بی کربنات موجود در آنها است، لذا قلیاییت نشانگر غلظت این ترکیبات در آبها نیز می باشد. حضور سیلیکات ها (SiO2-3) و فسفات ها (HPO2-4 , PO3-4) که مقادیر آنها به ترتیب در بعضی آبهای طبیعی و آب های صنعتی ( آب جوش آور ها) قابل توجه است در مقدار قلیائیت موثر است. از عوامل دیگر عوامل موثر می توان از بورات ها و بعضی مواد آلی نام برد. اندازه گیری های قلیائیت در تفسیر و کنترل فرآیند های تصفیه آب و پس آب کاربرد شایان توجهی دارند.
رابطه قلیائیت واسیدیته آب
قلیائیت و اسیدیته آب در رابطه بسیار نزدیک با مقدار CO2 حل شده در آن هستند، روابط شیمیایی مربوط به ترتیب زیر پیش بینی شده است:
Co2 + H2O H2Co3
H2Co3 HCo3- + H+
پروتون حاصل با کربنات کلسیم ترکیب شده و ضمن تبدیل کربنات به بی کربنات موجب افزایش حلالیت کربنات کلسیم می شود:
CaCo3 + H+ HCo3- + Ca2+
بطوری که در بالا اشاره شد، قلیائیت و اسیدیته در اعم کلمه به ترتیب مفهوم های "ظرفیت خنثی سازی اسید " و ظرفیت خنثی سازی باز را دارا هستند.
از دیدگاه شیمی تجزیه آبها و پس آبها مسائل و موضوعات بسیار متعددی در این امر دخالت دارند. در این مرحله به منظور تعمیم موارد کاربرد مفهوم قلیائیت به قلیائیت ناشی از یون های هیدرو کسید بی کربنات و کربنات بسنده شده است.
در صد حجمی CO2 موجود در هوا در مقایسه با اکسیژن (21%) و ازت (79%) مقدار ناچیز 04/0 % است. همین مقدار ناچیز CO2 از نظر تعادل حیات بر روی کره زمین از اهمیت فوق العاده زیاد برخوردار است.
آب باران ضمن بارش CO2 1PPM حل می کند در حالی که مقدار CO2 در آب مقطر در آب اشباع تا حدود 1600 PPM می رسد و مقدار PH به حدود 4 تقلیل می یابد. با افزایش PH اسید کربنیک حاصل به بی کربنات و در نهایت به کربنات تبدیل می شود. مقدار بی کربنات در PH=4 تقریبا صفر است. با افزایش PH، CO2 به بی کربنات تبدیل شده و مقدار آن به حداکثر مقدار ممکن افزایش می یابد.
اگر به افزایش PH ادامه داده شود ضمن تبدیل بی کربنات به کربنات مقدار آن کاسته می شود بطوری که در PH حدود 12 کلیه مقادیر بی کربنات به کربنات تبدیل شده است.
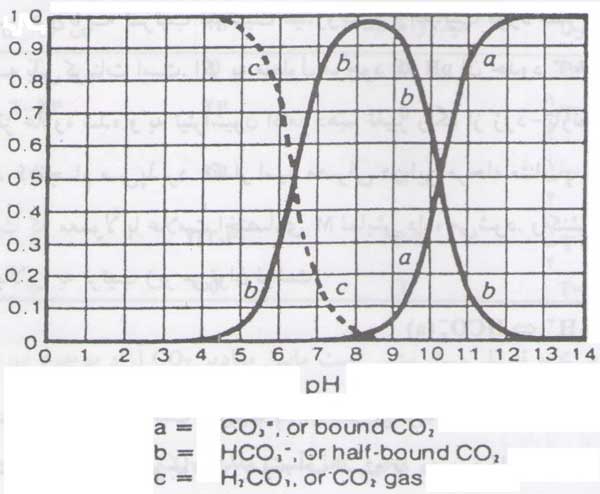
همانگونه که در شکل ملاحظه می شود جز مولی بی کربنات و اسید کربنیک در6/3 PH= و کربنات در 3/10 PH= با همدیگر برابر است. با توجه به روابط زیر، بر اساس اصل لوشاتولیه حرکت سیستم در جهت یک یا افزایش PH جهت رسیدن به تعادل جدید کاملا قابل انتظار است.
H2Co3 HCo3- + H+
H2Co3- Co32- + H+
قلیائیت آب به دو نوع تقسیم می شود که عبارتند از قلیائیت فنل فتالئین و متیل اورانژ. نمونه آبی با 12 PH= در نظر گرفته می شود. به این نمونه شناسگر فنل فتالئین که نقطه تغییر رنگ آن 3/8 است علاوه می گردد و سپس با علاوه اسید با مشاهده تغییر رنگ از ارغوانی به بی رنگ تیتراسیون لازم به عمل می آید. مقدار اسید مصرفی در این مرحله متناسب با قلیائیت فنل فتالیین است معمولا با علامت اختصاری P نشان داده می شود. با قبول این فرض که در محلول یون های OH- و HCO3- بطور همزمان نمی تواند وجود داشته باشد واکنش های مربوطه به تیتراسیون بالا را به ترتیب زیر می توان نوشت:
OH- + H+ H2O(a)
Co32- + H+ HCo3- (b)
مقادیر aو b به ترتیب قلیائیت هیدروکسید و قلیائیت هیدروکسید و قلیائیت مورد مصرف جهت تبدیل کربنات به بی کربنات است. اگر به محلول موجود که ph آن حدود 3/8 است شناسگر متیل اورانژ علاوه شده و به تیتراسیون ادامه دهیم تغییر رنگ زرد – نارنجی به سرخ در ph حدود 4 انجام می پذیرد. مقدار اسید مصرفی در این مرحله متناسب با قلیائیت متیل اورانژ است که معمولا با علامت اختصاری M نمایش داده می شود.
مقادیر b و c به ترتیب مربوطه به قلیائیت بی کربناتی حاصل از تغییر کربنات و بی کربنات اولیه محتمل موجود در نمونه آب است.
به مجموع قلیائیت های میتل اورانژ و فنل فتالئین قلیائیت کل اطلاق شده و به ترتیب زیر نشان داده می شود: T=M+P
در اصل مقدار قلیائیت باید بر حسب مقدار پروتون های مصرفی در تیتراسیون بیان شود ولی در صنعت آب با ضرب این مقدار در اکی والان مقدار CaCO3 نتایج آزمایش بر حسب کربنات کلسیم بیان می شود.
در آزمایشگاه های صنعتی جهت تعیین قلیائیت ها 100 میلی متر نمونه آب انتخاب و در حضور هر یک از شناساگر های مذکور در بالا توسط اسید کلریدریک N 02/0 تیتراسیون انجام می گیرد. اگر میلی لیتر های اسید کلریدریک مصرفی در نوبت اول و دوم باشد حاصل ضرب مقادیر مذکور در رقم ده به ترتیب قلیائیت فنل فتالئین (P) و متیل اورانژ (M) بر حسب میلی گرم در لیتر (PPM) کربنات کلسیم به دست خواهد داد. با جمع جبری دو رقم M و P قلیائیت کل محاسبه می شود.
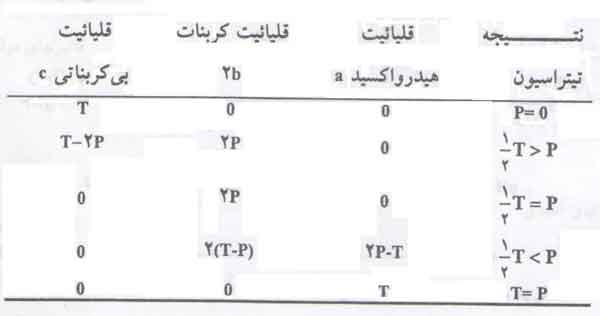
با وصف اینکه قلیاییت های هیدروکسید، کربنات و بی کربنات ترتیب برابر a، b2 و c هستند، روابط موجود ما بین انواع قلیاییت در جدول زیر نشان داده شده است.
بطوری که قابل پیش بینی است ما بین مقادیر co2 آزاد موجود در نمونه آب و قلیائیت متیل اورانژ (m) و ph آن رابطه مستقیم وجود دارد در شکل بالا این رابطه بطور تقریبی نشان داده شده است. در محور x ها نسبت مقدار co2 به قلیائیت متیل اورانژ و در محور y ها ph نمونه آب درج شده است.
به عنوان مثال اگر یک نمونه اگر قلیائیت یک نمونه آب با 9/6PH= برابر 150 PPM کربنات کلسیم باشد مقدار CO2 آزاد موجود در آن را به کمک شکل بالا می توان پیش بینی کرد. بطوری که در شکل ملاحظه می شود برای ph مورد نظر نسبت co2 به قلیائیت M برابر 3/0 است با ضرب مقدار 3/0 در رقم 150مقدار co2 آزاد بر حسب کربنات کلسیم 45 ppm پیش بینی می شود. در خاتمه یادآور می شود مقادیر می شود مقادیر مطلوب و مجاز قلیاییت کل برای آبهای آشامیدنی هر دو از 30 الی 500 میلی گرم کربنات کلسیم پیشنهاد شده است.
شرکت زادآب به عنوان برترین سازنده سختی گیر در ایران آماده ارایه خدمات و مشاوره به مدیران صنایع می باشد. برای دریافت اطلاعات بیشتر در خصوص سختی گیر با کارشناسان ما تماس بگیرید.
55256411 -12
09223345280
